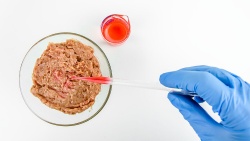
Aunque la carne cultivada es actualmente la que más portadas acapara, cada vez son más las starups y proyectos que están poniendo el foco en el pescado in vitro, en lo que se denomina acuicultura celular.
Se trata de un área de investigación que busca producir productos animales de consumo humano directo a través del cultivo de células de pescado, principalmente músculo.
El objetivo principal es el de prescindir de los animales y solo cultivar sus células. Sin embargo, por el momento la producción de células implica el uso de suero bovino. Éste se obtiene de fetos no nacidos e implica varios problemas. De una parte, requiere del sacrificio animal, lo que puede generar conflictos éticos con el consumidor objetivo.
Por otra parte, el coste es extremadamente elevado. La Universidad Davis de California calcula que medio kilo de carne de laboratorio puede llegar a costar 200 dólares. Además, al tratarse de material biológico de mamíferos puede entrañar riesgos de bioseguridad y transmisión de enfermedades entre especies.
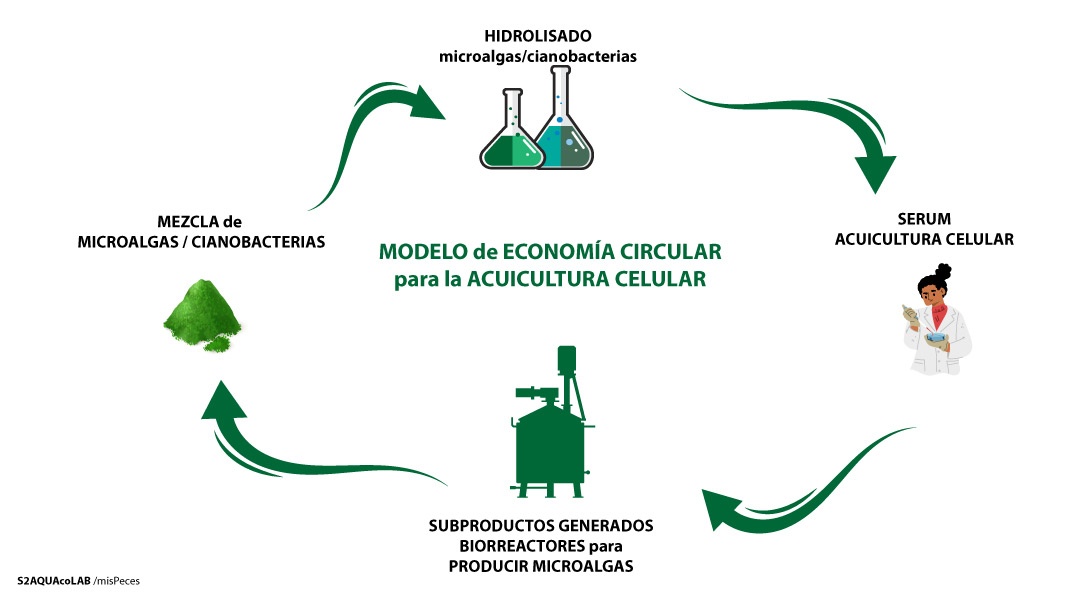
Esquema del proyecto circular del proyecto µCELLAQUA | S2AQUAcoLAB
Hidrolizado de microalgas como sustituto del suero bovino
En la vanguardia de esta innovación se encuentra S2AQUAcoLAB que recientemente ha recibido financiación para el proyecto µCELLAQUA que tiene como doble objetivo desarrollar un equivalente al suero bovino que sirva para el cultivo celular y, por otro lado, utilizar el medio resultante como fertilizante para cultivar microalgas.
El proyecto fue seleccionado durante el Cultivated Meat Innovation Challenge lanzado por GFI y el IET Food de la Unión Europea. Está financiado con 100 000 euros y participan en el mismo junto con S2AQUAcoLAB, GreencoLAB, Centro de Ciencias del Mar de la Universidad de Algarve, y Necton SA. Los investigadores del proyecto tienen probada experiencia tanto en el cultivo de microoalgas como de células animales de laboratorio.
El proyecto, como señalan al respecto Joana Rosa y Vincent Laizé para misPeces, tiene por objetivo evaluar el potencial de los hidrolizados de microalgas y cianobacterias para reemplazar el suero animal en el medio de cultivo celular, no solo reduciendo los costes, también haciéndolos más bioseguros y sostenibles.
En esta fase del proyecto, señala, se buscará que una mezcla de microalgas y cianobacterias de uso actual comercial - cuya relación y proporción no ha querido ser desvelada por motivos de confidencialidad - puedan sustituir el suero bovino. Este “suero” de microalgas servirá para el crecimiento de fibroblastos y mioblastos (células musculares) de peces.
Los investigadores esperan “desarrollar un sustituto rentable y libre de compuestos animales para la elaboración de este suero”.
La otra parte del proyecto tiene un enfoque de economía circular al dar uso a los residuos generados en el cultivo celular para emplearlos como medio de cultivo de microalgas en una prueba piloto. En el caso que esta prueba tenga el éxito esperado, se desarrollará un producto liofilizado ajustado a los requerimientos del cultivo de microalgas.
La producción de carne cultivada, también llamada inerte, sintética, de laboratorio o in vitro, aún está en una fase incipiente. La filosofía detrás de este enfoque innovador es el de producir productos acuáticos para una población mundial en crecimiento que demanda proteína sin que sea competitiva con los recursos naturales.
Como destacan los investigadores, en el contexto actual, la acuicultura celular no tiene la capacidad de producir la cantidad de proteína necesaria para complementar eficientemente las fuentes tradicionales que vienen de la pesca y la acuicultura y se enfrenta a varios cuellos de botella. Los principales, la provisión limitada de líneas celulares de origen de pescado y derivadas del músculo; la falta de medios sin suero para cultivar células de peces; tecnologías de reciclaje de los medios de cultivo; y capacidad para producir masivamente células en biorreactores.